暨南大学融媒体中心讯 2025年2月,暨南大学肿瘤分子生物学教育部重点实验室的张志毅研究员和何庆瑜教授团队在国际顶级期刊Signal Transduction and Targeted Therapy(IF: 40.8)发表了题为《The cryptic lncRNA-encoded microprotein TPM3P9 drives oncogenic RNA splicing and tumorigenesis》的研究成果,首次揭示了长链非编码RNA编码的微蛋白TPM3P9在肿瘤中的关键生物学功能及其作用机制。

人类蛋白质组计划(Human Proteome Project)的核心目标是全面鉴定并解析人类所有蛋白质,深入理解它们在人类生命活动和疾病中的作用。尽管目前科学界普遍认为,超过98%的基因是“非编码基因”(non-coding genes),即不直接编码蛋白质,但近年来,越来越多的研究表明,部分长链非编码RNA(lncRNA)不仅具有生物学功能,且能通过翻译产生成熟的微蛋白,参与生命活动的调控。
早在2013年,暨南大学何庆瑜教授团队就通过自主研发的翻译组测序技术(RNC-seq),在癌细胞中发现了1397个由非编码RNA翻译而成的“隐藏”蛋白质,并在《Nucleic Acids Research》期刊上发表了这一突破性成果。随后的2019年,该团队通过对肿瘤细胞的深入研究,系统地报道了4700种非编码基因在肿瘤细胞中的翻译现象,并提供了314个新蛋白的证据。然而,尽管这些非编码RNA编码的蛋白质已被发现,迄今为止,其生物学功能和在肿瘤发生发展中的作用尚未得到充分验证。
在该研究中,团队对CPTAC、CCLE数据库以及in-house的新鲜肿瘤和细胞样本的蛋白质组学数据进行了大规模筛选,揭示了隐藏在人类肿瘤中的lncRNA编码微蛋白。通过分析CPTAC中9种类型肿瘤的1000多名患者的蛋白质组学数据,研究团队发现了777个由lncRNA编码的蛋白质(LEPs),并在验证集的组织样本中检测到了其中的78个LEPs。结果显示,大部分LEPs在肿瘤及其癌旁组织中表现出差异表达,提示它们在肿瘤的发生和发展中可能发挥重要功能。
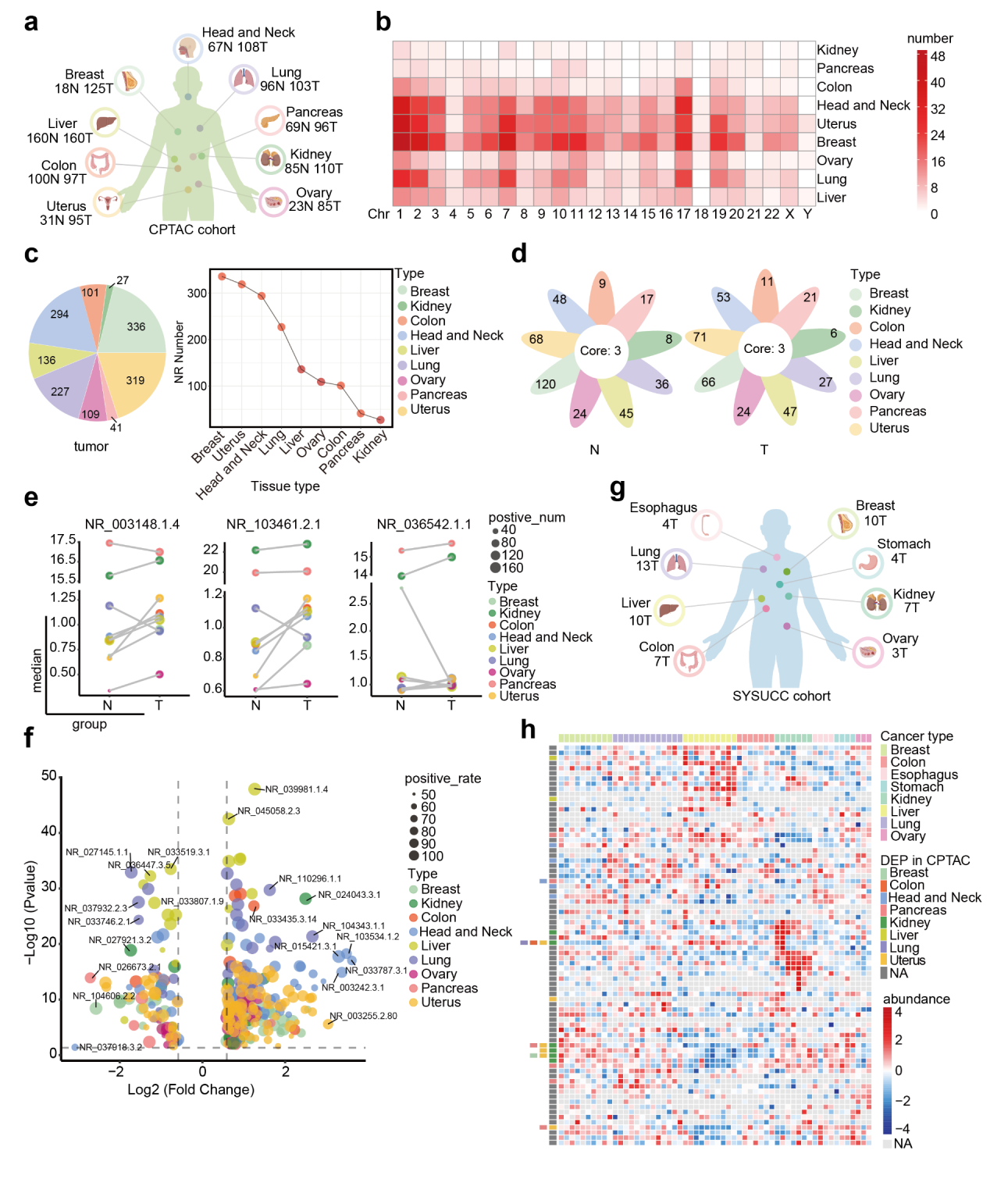
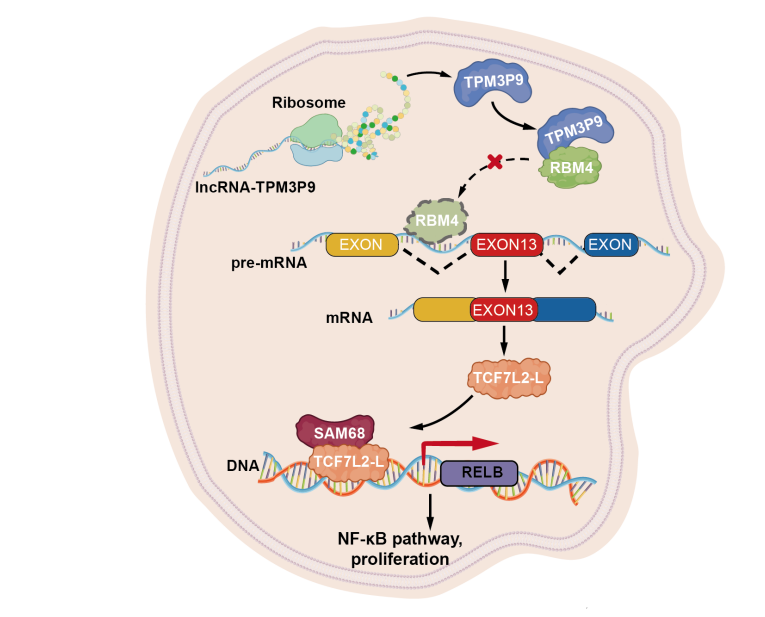
进一步研究表明,新蛋白TPM3P9在透明细胞肾细胞癌(ccRCC)中具有显著的临床意义和生物学功能。TPM3P9通过增强致癌RNA的选择性剪接,促进肿瘤的生长,并与患者的不良预后密切相关。TPM3P9与RNA 结合蛋白 RBM4的N端相互作用,抑制了RBM4对TCF7L2前体mRNA第13号外显子跳跃的调控作用,从而促进了TCF7L2-L变体的形成。TCF7L2-L与转录因子 SAM68结合上调RELB,进而激活NF-κB信号通路,促进ccRCC增殖。这一发现不仅为新蛋白TPM3P9作为ccRCC治疗靶点提供了理论依据,也强调了非规范开放阅读框翻译在肾癌中的关键作用。进一步探索这些非典型蛋白在癌症中的作用,将提升我们对恶性肿瘤发生发展的理解,为开发新型治疗策略提供视角。
论文链接:https://www.nature.com/articles/s41392-025-02128-8
责编:陈国琼