暨南大学融媒体中心讯 近日,生命科学技术学院生化系孙雪松研究员/何庆瑜教授团队在细菌耐药机制研究上取得重要成果,相关研究相继发表在国际知名期刊Cell reports (中科院一区,IF: 8.8,1篇)和Journal of Hazardous Materials(中科院一区,IF: 13.6,2篇)上。孙雪松研究员与何庆瑜教授为三篇论文的共同通讯作者,暨南大学硕士研究生庄建鹏、钟泰然和博士研究生房祖业分别为三篇文章的第一作者,暨南大学为第一通讯单位。上述研究得到国家重点研发计划、国家自然科学基金和广东省自然科学基金的支持。

细菌抗生素耐药性是全球健康和粮食安全的最大威胁之一,传统的抗生素已经失去原有的治疗效果,解决细菌耐药问题刻不容缓。为开发有效遏制耐药菌的广泛传播及防治相关感染的新策略,我们必须从全新的角度理解细菌耐药性的发生和发展过程。
蛋白质翻译后修饰(PTM)是调控蛋白质功能的关键生理过程。孙雪松/何庆瑜团队长期从事PTM对细菌毒力和耐药调控机制的研究,相关成果已经在mSystems等杂志发表多篇论文。前期研究发现乙酰化修饰针对不同类型抗生素耐药的大肠杆菌具有共同的调控机制:负向调控细菌能量代谢和正向调控运动性。修饰蛋白组分析显示糖酵解的关键酶-丙酮酸激酶PykF乙酰化在耐药菌中显著增强,PykF蛋白的413位赖氨酸的去乙酰化显著增加酶活性并促进细菌能量的产生,进而提升耐药菌对抗生素的敏感性。巴豆酰基与乙酰基结构类似,但巴豆酰基是一种独特的具有C-C π键的刚性短链疏水性酰基,然而人们对于细菌中赖氨酸巴豆酰化修饰的发生过程以及对耐药性的调控机制的认知相对匮乏。
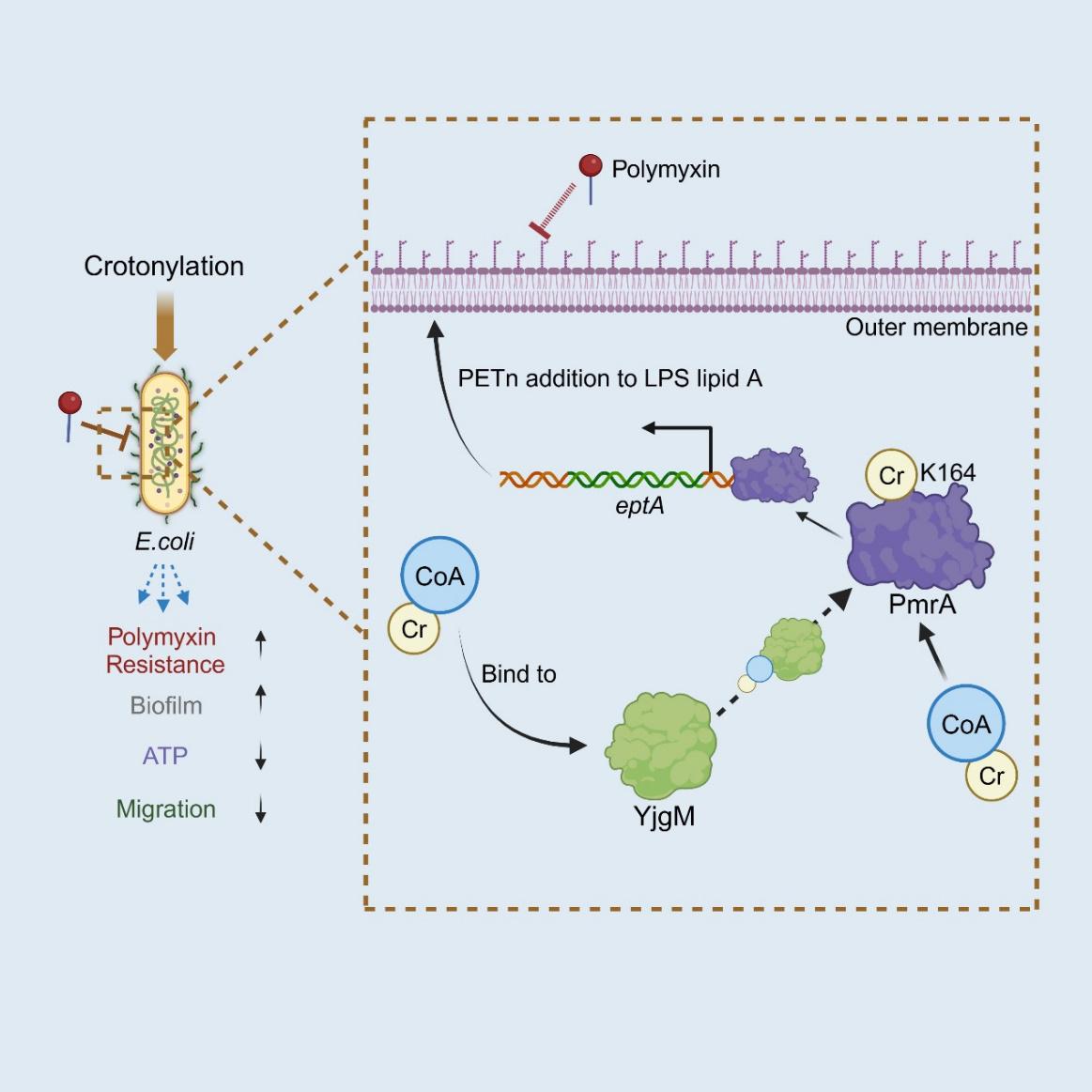
研究团队通过生信分析结合体内外实验发现并确证了大肠杆菌的一种巴豆酰转移酶YjgM,并利用定量修饰蛋白质组学鉴定了YjgM的关键底物-转录因子PmrA,PmrA通过结合在磷酸乙醇胺转移酶EptA以及糖基转移酶 PmrK/ArnT基因启动子区域促进其表达,进而提高细菌外膜脂多糖(LPS)的脂质A修饰水平,最终导致细菌对多黏菌素产生抗性。该研究揭示了巴豆酰化修饰在细菌对"最后一道防线"-多黏菌素耐药性形成过程中的关键调节作用,为耐药菌的防治提供了新视角。以上成果于2024年4月27日发表在Cell Reports。
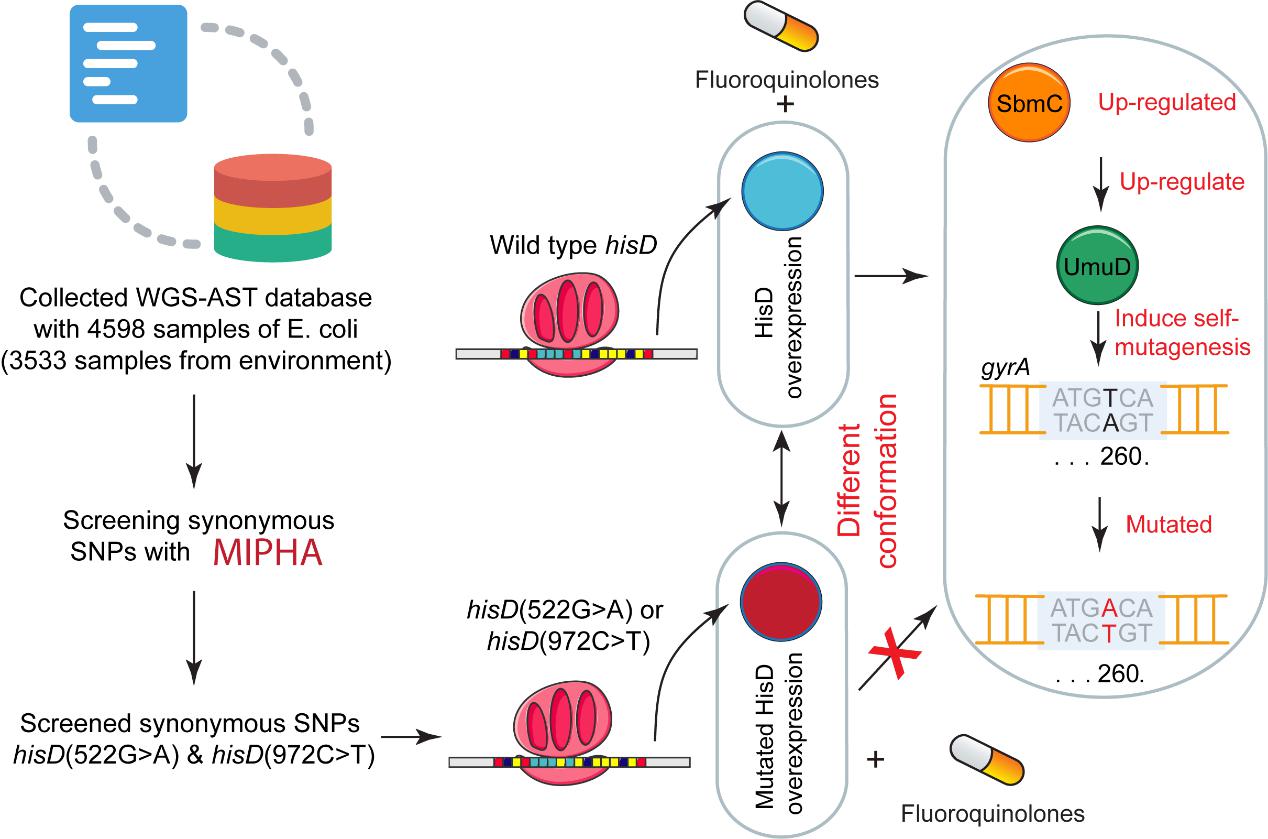
同义突变(synonymousmutation)过去一直被认为是无功能的,因为它并不改变蛋白质的氨基酸序列。然而,近年同义突变的生物学功能逐渐被人们发掘。研究团队通过自主开发的算法“MIFHA”对4598株大肠杆菌全基因组测序(WGS)和表型数据进行分析,鉴定了发生在hisD基因上两个重要的同义突变(522 G>A 和 972 C>T),其与氟喹诺酮类抗生素耐药性相关。进一步的机制研究表明:hisD 通过上调 sbmC 和其下游基因 umuD,从而引发 gyrA 突变。两个同义突变通过减缓HisD蛋白的翻译,改变其构象,进而使其失去上述调节功能,最终导致细菌失去对抗生素的抵抗能力。该研究揭示了长期被忽视的同义突变对细菌耐药性调控机制,为系统阐明细菌耐药性发生和发展过程提供了新思路。以上成果于2024年5月5日发表在Journal of Hazardous Materials。
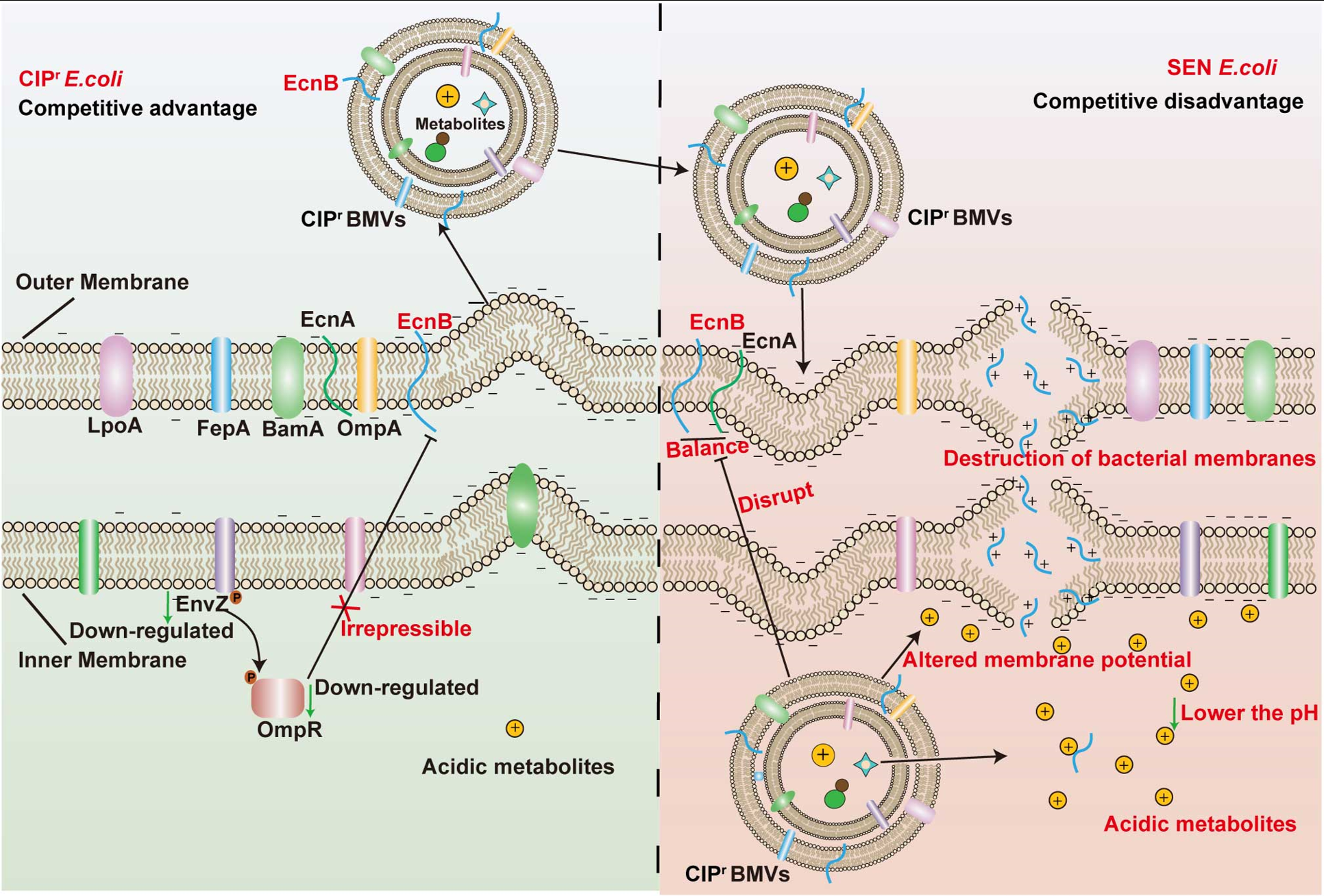
研究团队同时关注耐药菌在环境中生存以及传播的分子机制,发现低浓度的药物诱导的耐药菌相对敏感菌在无抗生素环境下具有竞争性生长优势。通过细菌外膜囊泡蛋白组和代谢组及生化分析发现:环丙沙星耐药大肠杆菌通过外膜囊泡(BMVs)携带肠毒素蛋白EcnB裂解敏感菌,BMVs中的小分子代谢物酸化敏感菌环境,增强了EcnB溶菌能力,从而使耐药菌在生存环境中获得竞争优势,使其易于在环境中传播,揭示了BMVs在介导细菌种群之间相互竞争中的重要作用。这项研究标志着团队在耐药性细菌在无抗生素压力环境中传播的动力学方面取得了重要进展,提示调节BMVs的产生和干预细菌菌群间竞争有望成为控制耐药菌传播的新策略。以上成果于2024年5月5日发表在Journal of Hazardous Materials.
责编:李伟苗