暨南大学融媒体中心讯 高度官能团化的氧杂蒽类化合物具有显著的生物活性。然而,由于其复杂的环系结构、多手性中心及高氧化态,合成该类化合物面临诸多挑战。暨南大学叶文才/王磊/程民井团队前期发展了光延反应介导的手性拆分方法,实现了多种氧杂蒽类天然产物的首次不对称全合成(Nat. Commun.2024, 15, 5879)。近期,为了避免依赖手性拆分方法,作者在分离鉴定的螺环天然产物myrtuspirone A的化学结构启发下(Org. Lett.2019, 21, 1583),提出了一种基于螺环底物的光催化骨架重排策略,成功应用于myrtucomvalones E-F的首次不对称全合成,并与刘畅副研究员合作发现了具有显著抗骨肉瘤活性的化合物。相关研究成果发表于Angew Chem In Ed(DOI:10.1002/anie.202420671),暨南大学博士研究生林诗琳、硕士研究生赵芬和魏芬为共同第一作者。

作者通过大量条件筛选确定了光催化骨架重排反应的最优条件,并考察了不同取代基的螺环底物的适用范围。结果表明,该方法能够快速合成不同取代的高度官能团化氧杂蒽类化合物。进一步,以该方法为关键反应,通过6-7步实现氧杂蒽类天然产物myrtucomvalones E-F的不对称合成。在反应机制研究中,作者通过氢转移实验验证了反应的立体化学特性,确认该方法不会引发消旋化现象。此外,通过开关灯、自由基捕获及Stern-Volmer荧光淬灭等实验,揭示了光催化骨架重排反应的可能机理(图1)。
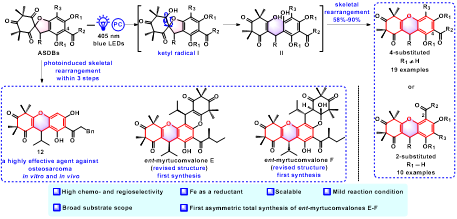
(图1. 光催化骨架重排新策略及其应用)
在合成工作完成后,作者进行了抗骨肉瘤细胞活性评价,并通过小鼠骨肉瘤肺转移模型对活性最强的化合物12进行了体内药效研究。结果表明,该化合物显著抑制了骨肉瘤的生长(图2)。
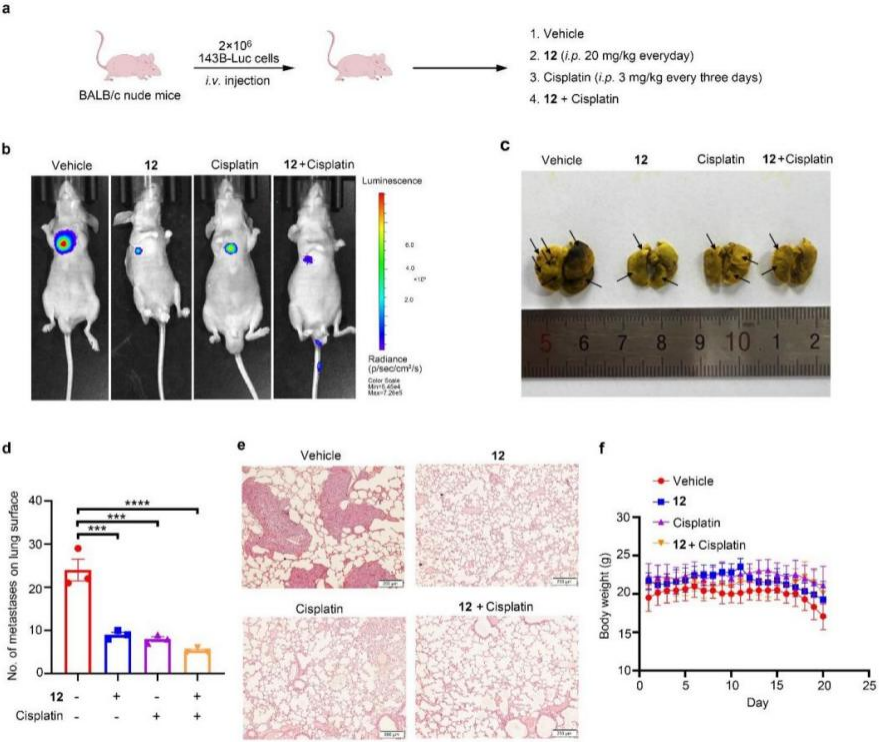
(图2. 化合物12显著抑制骨肉瘤的生长)
综上,该论文发展了光催化骨架重排新策略,成功合成了一系列高度官能团化的氧杂蒽类化合物,并发现了具有显著抗骨肉瘤活性的化合物,为研发新型抗骨肉瘤药物提供了科学依据。
论文链接:https://doi.org/10.1002/anie.202420671。
责编:陈国琼