暨南大学融媒体中心讯 近日,暨南大学生命科学技术学院生化系陈良教授、周倩副研究员和药学院丁克教授合作,在国际顶级期刊Science Advances(中科院一区TOP期刊,IF=11.7)发表题为“Human/mouse CD137 agonist, JNU-0921, effectively shrinks tumors through enhancing the cytotoxicity of CD8+ T cells in cis and in trans”的研究论著,报道了首个CD137小分子激动剂JNU-0921的开发及其在肿瘤免疫治疗中的作用机制。

CD137是T细胞表面重要的免疫共刺激分子,其在免疫细胞的发育、调节免疫反应和促进T细胞活化中扮演着关键角色。临床前动物实验中,CD137的激动剂能完全清除肿瘤,成为药业界的热门靶点。目前已有多个抗体类药物进入临床试验,但这些药物在毒性和药效等方面的表型不如人意。原因是目前正在研发的抗体药,只能识别人的CD137蛋白,不识别模式动物的CD137,造成抗体药的体内药效和机理无法评估。针对这一困境,陈良教授团队研发出能同时识别人和小鼠CD137蛋白的小分子激动剂JNU-0921,并利用小鼠模型评价该药物的体内药效、毒性和药理机制;发现JNU-0921具有较高的组织穿透能力,对人类的抗原性低,制造/运输/存储相关的成本低以及管理方便等优点。JNU-0921是全球范围内首个CD137小分子药物。
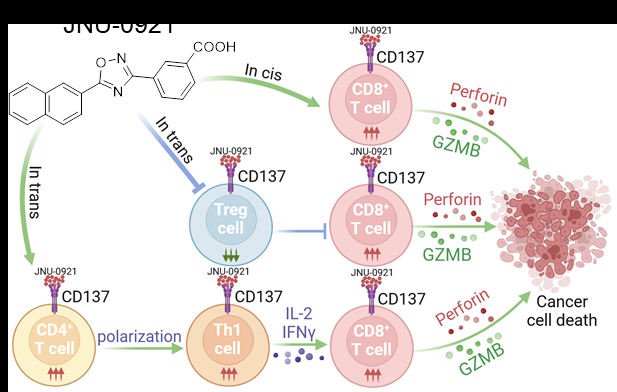
图1. CD137小分子激动剂JNU-0921抗肿瘤机理示意图
研究团队建立高通量筛选体系,鉴定出FDA批准的老药阿塔卢纶(Ataluren,记为AT)具有CD137激动剂的特性,但AT激活CD137的能力弱,特异性不强。作者对AT的化学结构进行了系统优化,得到了高效、高特异性的CD137激动剂JNU-0921。JNU-0921通过直接与CD137的胞外结构域结合,促进CD137的多聚化激活;JNU-0921治疗能显著激活肿瘤微环境中CD8+T细胞的效应和记忆功能,同时抑制Treg细胞的功能。团队进一步阐明了JNU-0921的药理机制:一方面,JNU-0921增强CD8+T细胞的效应及记忆功能;另一方面,JNU-0921能通过促进Th1细胞和抑制Treg细胞的功能进而增强CD8+T细胞的抗肿瘤能力。
该工作是我校不同学科交叉的强强联合,攻克了目前药学界中一个公认的难题。JNU-0921结合并激活CD137信号传导机理的阐明,为药学界开发CD137的小分子激动剂打开了一个全新的局面,为CD137激动剂用于临床奠定了理论基础。本文的通讯作者为暨南大学陈良教授、丁克研究员和周倩副研究员,共同第一作者为刘鹭(PhD,暨南大学博士后)、陈峰华(MD,暨南大学)、李姗(PhD,中国科学院杭州医学研究所)和杨童(博士生,暨南大学)。
原文链接:https://www.science.org/doi/10.1126/sciadv.adp8647
责编:陈国琼