暨南大学融媒体中心讯 广东省小核酸药物开发工程技术研究中心主任、基础医学与公共卫生学院费嘉教授团队于2024年8月23日在国际权威期刊Cell Death & Disease(中科院1区,Top期刊)在线发表题为“Small RNA activation of CDH13 expression overcome BCR-ABL1-independent imatinib-resistance and their signaling pathway studies in chronic myeloid leukemia”的研究论文。

图 1. 发表论文的截图
第一代酪氨酸激酶抑制剂 (TKI) 伊马替尼耐药性的发生是治疗慢性粒细胞白血病(chronic myeloid leukemia, CML)的临床难题之一,其中BCR-ABL1依赖性耐药已通过第二代和第三代TKI药物的治疗得到较好的解决。而BCR-ABL1非依赖性耐药由于机制复杂和多样性,目前还没有公认有效的治疗方法。该团队前期发现抑癌基因CDH13在CML BCR-ABL1非依赖性耐药细胞株中由于高甲基化导致低水平表达,但其对CML耐药细胞的作用以及相关机制尚不清楚。
RNA激活(RNA activation, RNAa)是一种由小双链 RNA (dsRNA) 介导的基因调控机制,其靶向基因启动子序列,从而激活基因的转录。相比较传统的核酸药物主要通过下调基因发挥作用,RNAa 作为 RNA 世界的新兴成员,可实现内源性基因的上调。不仅提供了一个新的平台进行基因功能研究,而且还展示了特殊的临床治疗潜力。
该研究基于RNAa技术,设计了靶向CDH13启动子区域的saRNAs序列。并使用RT-qPCR和Western blot蛋白印迹筛选出,成功激活敏感细胞K562、KCL22、KU812、NB4和耐药细胞K562-IMR、KCL22-IMR细胞中CDH13的mRNA和蛋白表达水平,并能抑制细胞的相对活力与克隆形成能力的有效序列。在K562-IMRluci异种移植小鼠模型中,经LNP包裹的CDH13-saRNA药物能有效抑制K562-IMRluci细胞在体内的生长,并延长小鼠的存活时间。Western blot实验筛选发现在K562-IMR细胞中上调CDH13表达后,抑制NF-κB信号通路的传导,下调癌基因c-myc、Bcl-2和MDM2的表达,促进了CML耐药细胞的凋亡。
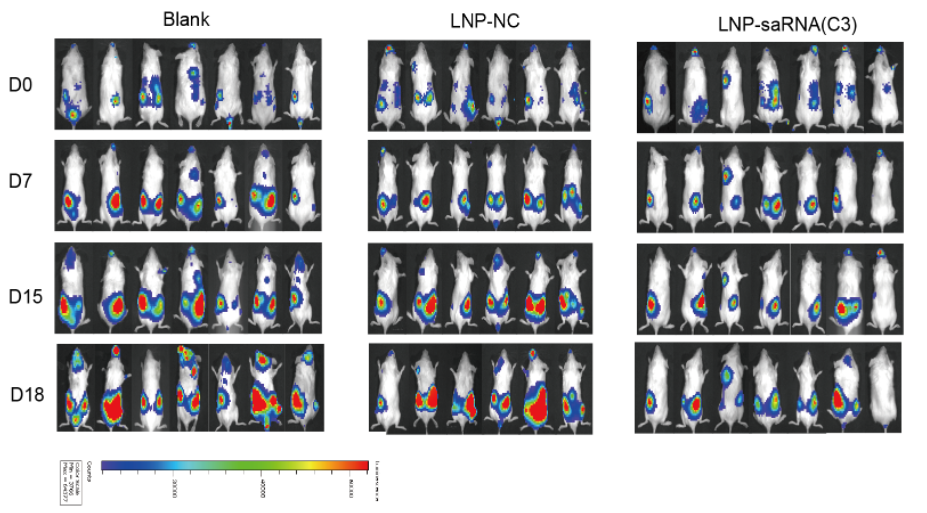
图 2. LNP-CDH13-saRNA药物能有效抑制K562-IMRluci细胞在小鼠体内的生长
费嘉教授该研究团队利用CDH13-saRNA靶向激活CDH13的表达,抑制CML耐药细胞中NF-κB信号通路传导,促进凋亡的发生,为克服CML BCR-ABL1非依赖性耐药提供一种新的可行性方案。
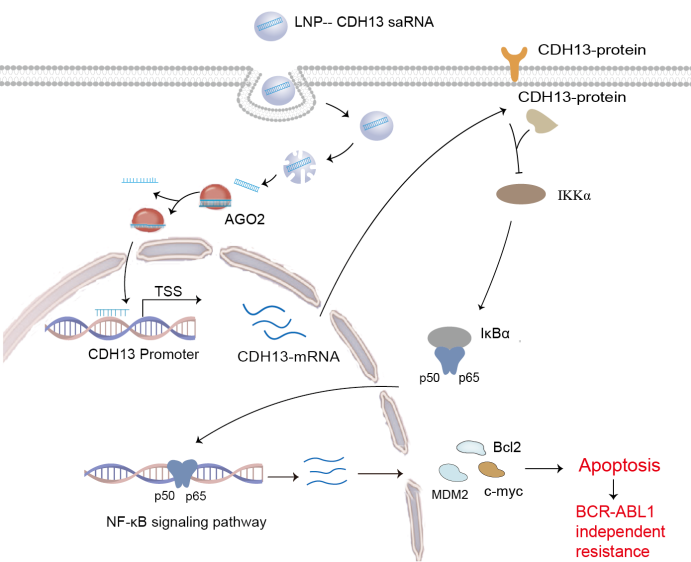
图 3. 研究论文的图形摘要
论文共同第一作者为暨南大学苏睿博士生、文紫琪硕士生、詹兴日硕士生和龙怡伶硕士生,暨南大学基础医学与公共卫生学院费嘉教授与生命科学技术学院苏玉斌副教授为共同通讯作者。该项目获得2022年广州市科技计划重点研发项目的支持(No. 202206010063)。
原文链接: DOI: 10.1038/s41419-024-07006-9
责编:李伟苗