

暨南大学融媒体中心讯 近日,暨南大学中药生物技术研究所朱建华教授和于荣敏教授团队在nature commnications期刊发表题目为“Dihydroartemisinic acid dehydrogenase-mediated alternative route for artemisinin biosynthesis”的研究成果。该研究首次报道了一种来自黄花蒿的二氢青蒿酸脱氢酶(Dihydroartemisinic acid dehydrogenase,AaDHAADH),AaDHAADH能够催化AA和DHAA之间的双向转化。研究团队通过定点诱变技术获得了该酶的定向优化突变体(活性提高2.82倍),实现了AA到DHAA的高效转化,并且在酿酒酵母中实现了DHAA的从头合成,通过补料分批发酵在5 L生物反应器中实现了3.97 g/L的DHAA产量。为ART的生物合成提供了一条更加便捷、高效的生产途径。

论文封面
背景介绍:
2006年,D.K.Ro等人首次实现工程化酵母菌株发酵生产青蒿酸(Artemisinic acid,AA)——抗疟疾药物青蒿素(Artemisinin,ART)的前体化合物,开启了采用合成生物学方法生产青蒿素类化合物(Artemisinins,ARTs)的新篇章。
2013年,C.J.Paddon等人通过对ART生物合成进行工程化改造和定向整合,实现高产量AA的生产(25 g/L,5 L发酵罐)。随后他们通过AA化学合成二氢青蒿酸(Dihydroartemisinic acid,DHAA),再经DHAA自动氧化实现半合成法生产ART。但化学合成和多步自动氧化步骤仍面临产量损失,成本过高等问题,导致目前ART的市场来源仍然主要依赖于直接从黄花蒿植株中提取获得。
在ART的生物合成途径中,AA经DHAA转化为ART是目前最优的路径(Km,ALDH1 to AO,.58 μM,Km+EDBR2 to AO+E9 μM,代谢流倾向于生成AA),而催化AA生物合成DHAA的关键酶一直未被发现(图1)。
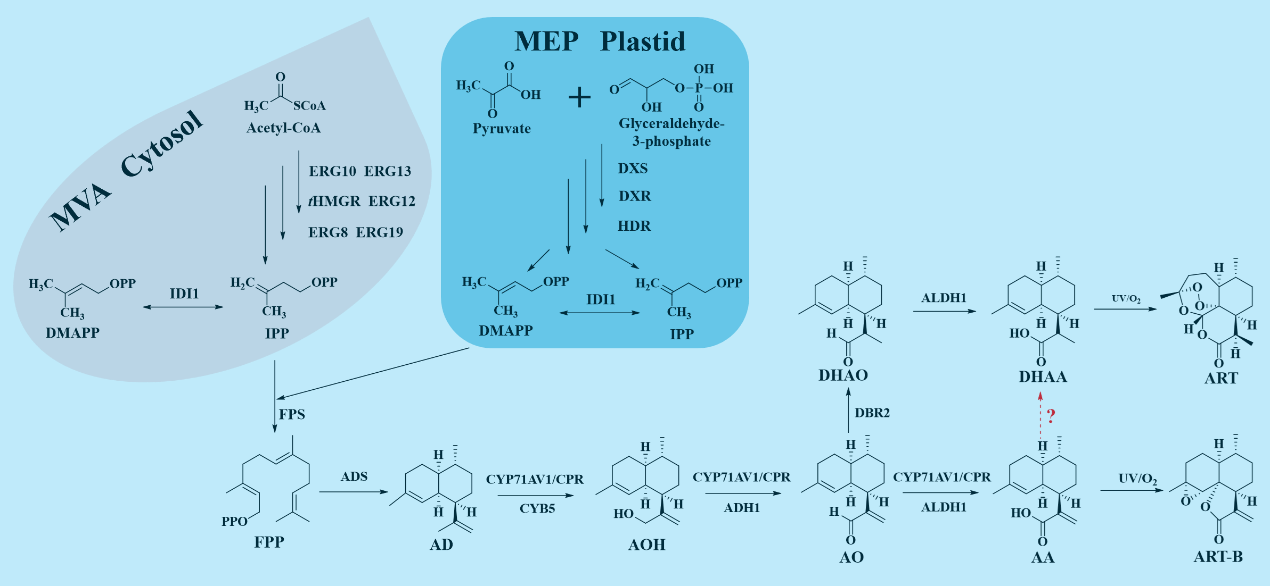
图1 ART的生物合成途径线路图
研究内容简介:
关键酶的挖掘和功能验证:
本研究创新性地采用以活性导向的蛋白纯化、蛋白质组学和生物信息学技术相结合的策略,成功地从复杂的植物粗酶体系中富集到目标酶,为鉴定低丰度酶和阐明未知中间产物的天然产物生物合成途径提供了新思路。
本研究在酶功能验证中不仅建立异源表达体系(大肠杆菌和本氏烟草),还将候选基因在内源宿主(黄花蒿细胞)中进行功能验证,该方法更接近酶的天然催化环境,可以真实反映其生理作用,弥补了异源表达系统的不足。同时,过表达和RNAi干扰实验的结果相互印证,进一步确证了AaDHAADH在催化AA/DHAA转化和ART生物合成中的关键作用(图2)。
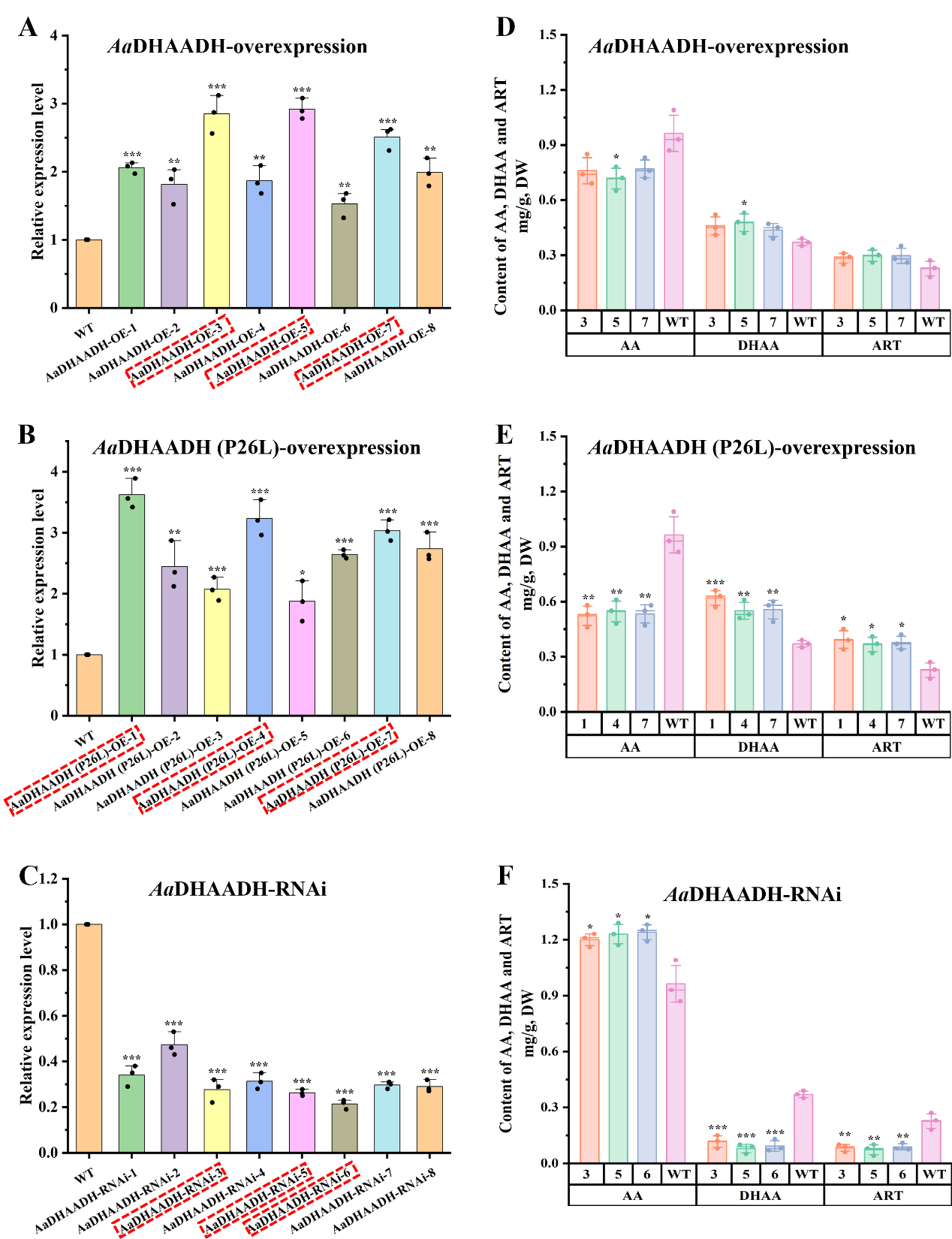
图2 转基因黄花蒿细胞系中AaDHAADH的相对表达情况及化合物AA、DHAA和ART的含量变化。
在酿酒酵母中从头合成DHAA:
为了实现DHAA的发酵生产,作者通过对MVA途径(ERG10、ERG19、IDI1、tHMG1和ERG20)和ART下游生物合成途径中的关键基因(ADS、CYP71AV1、CPR、ALDH1、ADH1、CYB5和AaDHAADH(P26L))进行定向整合,得到高产DHAA的酿酒酵母底盘菌株(菌株DHAA-2)。菌株DHAA-2在250 mL摇瓶中的发酵产量为0.35 g/L,采用5 L生物反应器对菌株DHAA-2进行分批补料发酵,在216 h时DHAA的产量达到3.97 g/L(图3)。AaDHAADH的发现,为半合成法生产ART提供了一条更加经济、高效的DHAA来源途径。
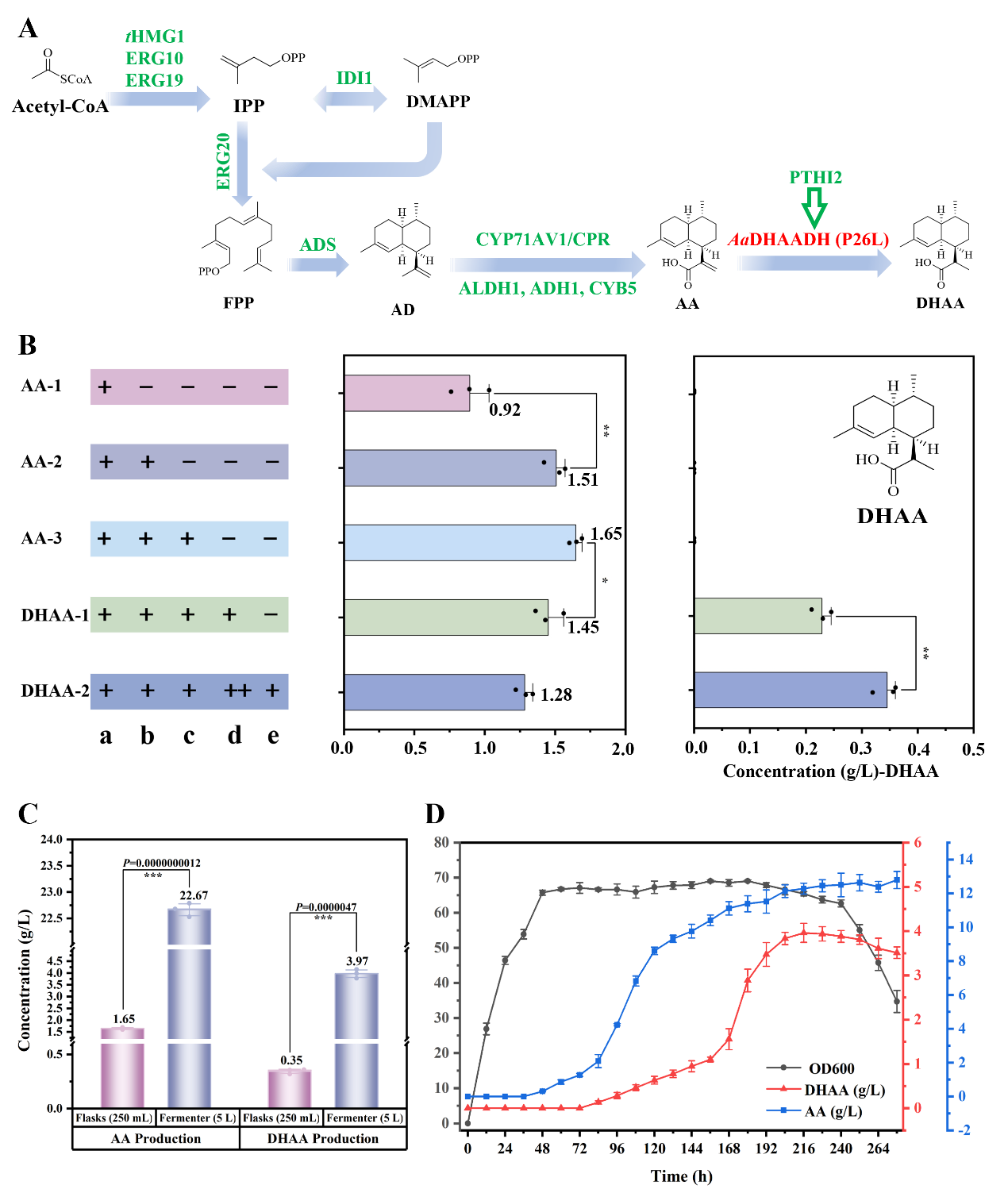
图3 酿酒酵母中DHAA的代谢工程
A:ART生物合成途径关键基因的整合;B:摇瓶发酵中AA与DHAA的产量(a:tHMG1+ERG10+ERG19+IDI1+ERG20+ADS+CYP71AV1;b:CPR+ALDH1;c:CYB5+ADH1;d:AaDHAADH(P26L);e:PTHI2);C:菌株DHAA-2与AA-3的摇瓶发酵与5 L生物反应器发酵的产量;D:菌株DHAA-2在5 L生物反应器中的生长及产量。
在本氏烟草中重构ART的生物合成途径:
基于DHAA可以自动氧化生成ART的特性,作者通过瞬时表达ART生物合成途径中的关键基因(tHMG1、ERG20、ADS、CYP71AV1、CPR、CYB5、ADH1、ALDH1和AaDHAADH(P26L)),在本氏烟草中重构ART的生物合成途径(图4-A)。通过在本氏烟草中共表达ADS、CYP71AV1和CPR,发现AA的产量为0.28 mg/g DW(图4-B,D)。当引入ADH1、ALDH1和CYB5后,AA产量提升至0.62 mg/g DW(图4-B,D)。进一步通过添加MVA途径的关键基因tHMG1和ERG20优化瞬时表达系统,成功将AA产量提高至1.19 mg/g DW(图4-B,D)。加入定向优化的活性酶AaDHAADH(P26L)后,DHAA产量达到0.51 mg/g DW(图4-C,D),但在瞬时表达的本氏烟草中未检测到ART。为加速DHAA自动氧化生成ART,作者对本氏烟草叶片进行紫外线照射处理,最终检测到ART产量为0.041 mg/g DW(图4-C,D)。
利用本氏烟草瞬时表达系统重构AA/DHAA/ART生物合成途径,不仅证实了 AaDHAADH在异源植物体内的催化功能,也为后续工程化植物合成ART积累了重要的元件和思路,对探索ART转运机制、提高植物合成效率具有重要意义。同时,这一研究也揭示了DHAA经自动氧化生成ART的化学转化机制,进一步佐证了DHAA是ART生物合成的直接前体。
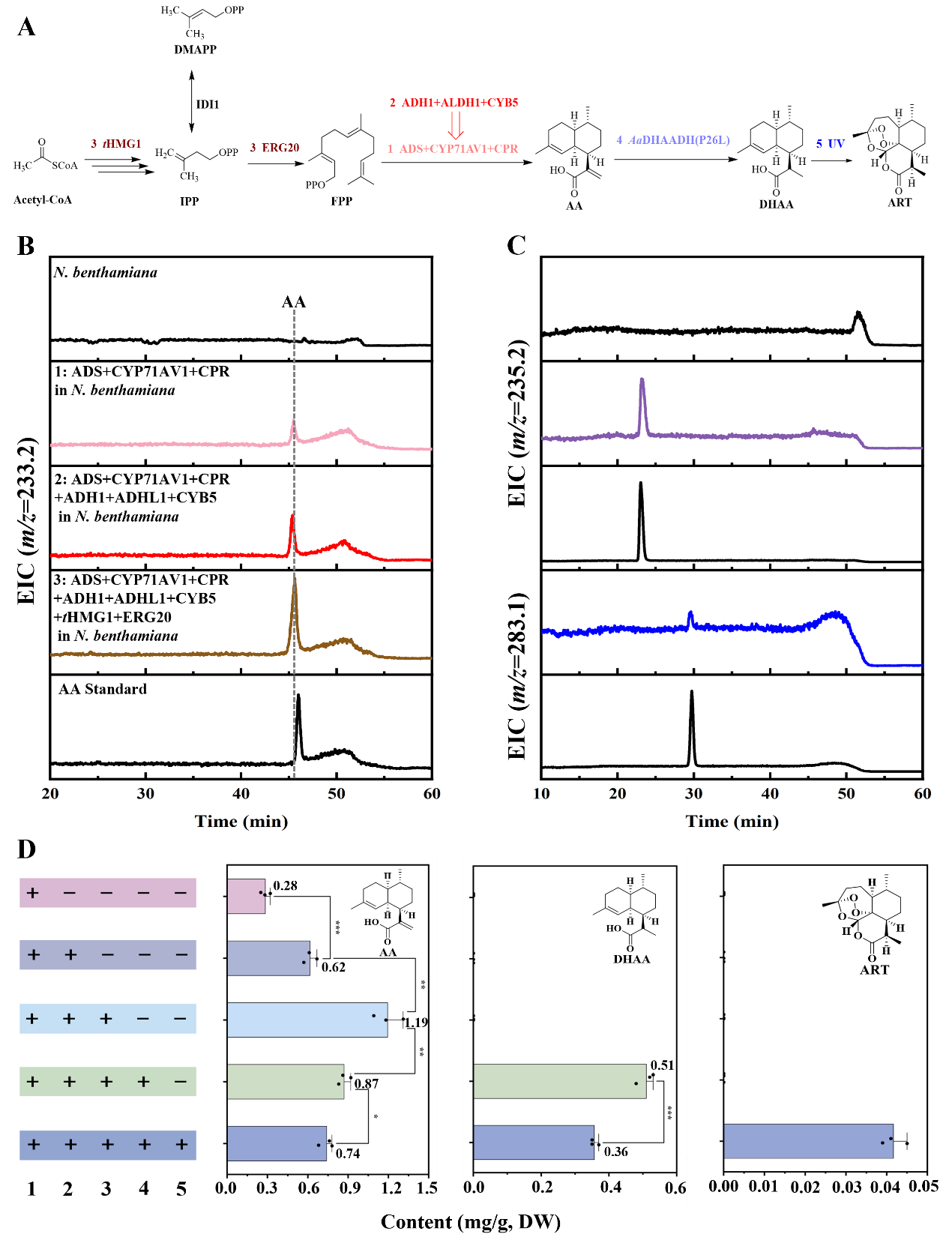
图4 在本氏烟草中重构ART的生物合成途径
A:在本氏烟草中ART的生物合成线路图;B:在本氏烟草中瞬时表达关键酶生产AA的LC-MS检测(m/z=233.2);C:在本氏烟草中瞬时表达关键酶生产DHAA(m/z=235.2)和ART(m/z=283.1)的LC-MS检测;D:不同基因组合侵染处理的烟草叶片中产物AA、DHAA和ART的含量。
结论:
本研究在ART生物合成中成功鉴定获得活性酶AaDHAADH,填补了AA生物合成DHAA关键酶的空白。同时,本研究在酿酒酵母中实现了DHAA的从头合成,在5 L生物反应器中的产量达到3.97 g/L,展现了良好的应用前景。此外,本研究在本氏烟草中重构了ART的生物合成途径,进一步验证了AaDHAADH在植物体内的催化功能,也为ART的工程化植物合成提供了新的元件和思路。
论文链接:https://doi.org/10.1038/s41467-025-59312-1
责编:周会谦