

暨南大学融媒体中心讯 近日,暨南大学基础医学与公共卫生学院范骏、中医学院戴勇和南京市第一医院周丹阳团队在中科院一区top期刊Advanced Science(IF=14.3)上发表了题为“Phosphorylation of POU3F3 Mediated Nuclear Translocation Promotes Proliferation in Non-Small Cell Lung Cancer through Accelerating ATP5PF Transcription and ATP Production”的研究成果,深入探讨了非小细胞肺癌(NSCLC)中,八聚体结合蛋白3(POU3F3)异常高表达通过促进NSCLC细胞ATP生成,进而推动NSCLC进展的具体分子机制。

文章标题页截图
肿瘤细胞即使在氧气充足的情况下,也倾向于通过糖酵解途径获取能量,这一现象被称为瓦博格效应(Warburg effect)。然而,近年来的研究表明,氧化磷酸化(OXPHOS)仍然是肿瘤细胞获取能量的重要途径,并且靶向氧化磷酸化的策略在癌症治疗中显示出显著的临床效果。八聚体结合蛋白家族成员在肿瘤的发生发展中起着关键作用,然而关于POU3F3在肿瘤中作用的研究相对较少。研究团队发现,POU3F3在NSCLC组织和细胞中显著上调,并促进了ATP的生成。机制上,上调的POU3F3进入细胞核,促进合成酶亚基ATP5PF的转录,增强了ATP合成酶各亚基之间的结合,从而促进了ATP合成酶的活性。
此外,研究团队发现POU3F3是RAS-RAF-MEK-ERK信号通路的下游靶点。ERK1通过结合并磷酸化POU3F3的S393位点,促进了由importin β介导的POU3F3核转位进程。进一步研究表明,突变型RAS抑制剂RMC-7977可以通过抑制RAS-RAF-MEK-ERK信号通路,从而抑制ERK的激活,减少POU3F3的核定位及其随后的ATP合成酶活性。
本研究的主要科学贡献包括首次揭示了POU3F3对NSCLC能量代谢的调控功能;发现POU3F3通过启动ATP合成酶复合物亚基ATP5PF的转录,显著增强了ATP合成酶的功能和ATP的生成;鉴定出POU3F3与ERK1的相互作用,明确了其磷酸化位点,并阐明了POU3F3核转位的分子机制。上述结果不仅加深了对NSCLC发展分子机制的理解,还为药物靶点的开发提供了坚实的理论基础。
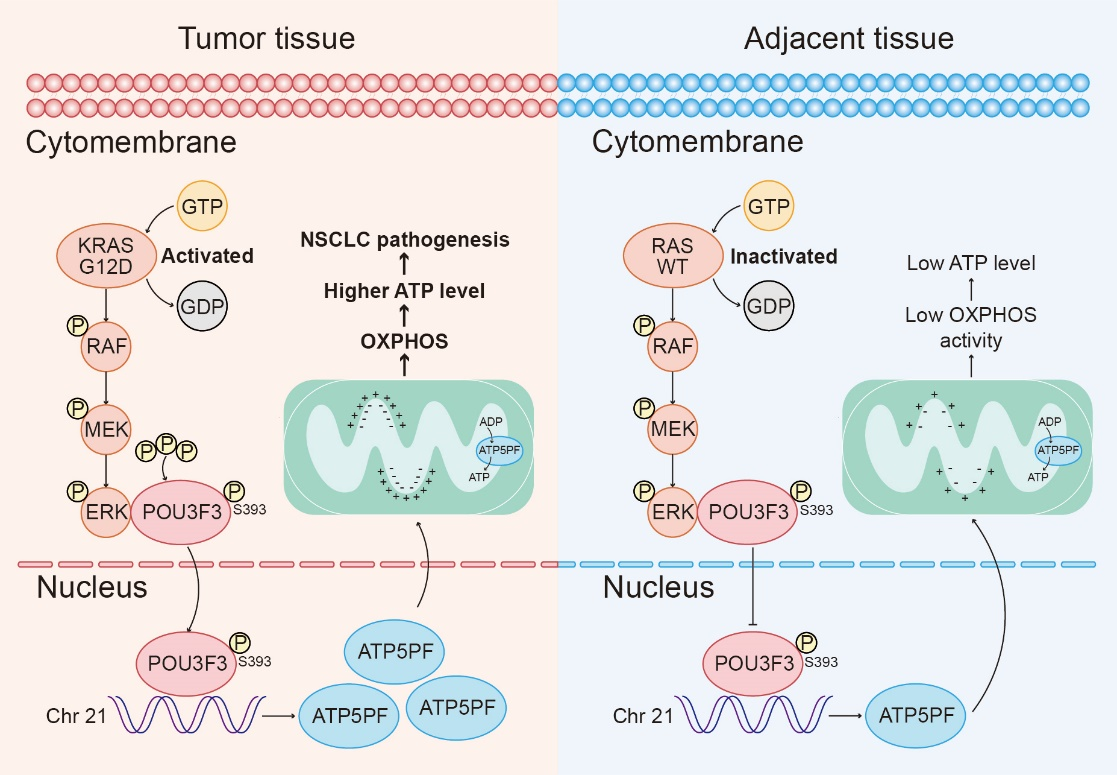
POU3F3通过促进OXPHOS和ATP的产生,进而促进NSCLC进展,并上调了ATP5PF的转录的机制示意图
暨南大学李乐、曾琦冈、常桃、孙勇和郑斌为本文的第一作者,暨南大学范骏、戴勇和南京市第一医院周丹阳为本文的通讯作者。
全文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202411503
责编:苏倩怡